10 класс. Химия. Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
10 класс. Химия. Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
Комментарии преподавателя
Изомеры - вещества с одинаковым строением молекулы, но разными химическим строением и свойствами.
Виды изомерии
I. Структурная – заключается в различной последовательности соединения атомов в цепи молекулы:
1) Изомерия цепи
Следует отметить, что атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
2) Изомерия положения
3) Изомерия межклассовая
4) Таутомерия
Таутомери́я (от греч. ταύτίς — тот же самый и μέρος — мера) — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. При этом устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров в определённом соотношении. Чаще всего при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении.

II. Пространственная (стерео) – обусловлена различным положением атомов или групп относительно двойной связи или цикла, исключающих свободное вращение соединённых атомов углерода
1. Геометрическая (цис -, транс – изомерия)
2. Оптическая
Если атом углерода в молекуле связан с четырьмя различными атомами или атомными группами, например:
то возможно существование двух соединений с одинаковой структурной формулой, но отличающихся пространственным строением. Молекулы таких соединений относятся друг к другу как предмет и его зеркальное изображение и являются пространственными изомерами.
Изомерия этого вида называется оптической, изомеры – оптическими изомерами или оптическими антиподами:
Молекулы оптических изомеров несовместимы в пространстве (как левая и правая руки), в них отсутствует плоскость симметрии.
Таким образом,
- оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптические изомеры аминокислоты
3. Конформационная изомерия
Следует отметить, что атомы и группы атомов, связанные друг с другом σ -связью, постоянно вращаются относительно оси связи, занимая различное положение в пространстве друг относительно друга.
Молекулы, имеющие одинаковое строение и различающиеся пространственным расположением атомов в результате вращения вокруг С–С связей, называются конформерами.
Для изображения конформационных изомеров удобно пользоваться формулами – проекциями Ньюмена:
|
|
|
|
|
|
Заслоненный конформер |
Заторможенный конформер |
||
Явление конформационной изомерии можно рассмотреть и на примере циклоалканов. Так, для циклогексана характерны конформеры:
|
кресло |
ванна |
Рассмотренные нами ранее виды формул, описывающих органические вещества, показывают, что одной молекулярной может соответствовать несколько разных структурных формул.
Например, молекулярной формуле C2H6O соответствуют два вещества с разными структурными формулами – этиловый спирт и диметиловый эфир. Рис. 1.
Этиловый спирт – жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,50С. При тех же условиях диметиловый эфир – газ, не реагирующий с натрием, кипит при -230С.
Эти вещества отличаются своим строением – разным веществам соответствует одинаковая молекулярная формула.

Рис. 1. Межклассовая изомерия
Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства называют изомерией (от греческих слов «изос» – «равный» и «мерос» – «часть», «доля»).
Типы изомерии
Существуют разные типы изомерии.
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир – структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой. Рис. 1.
3. Изомерия по углеродному скелету
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C5H12 соответствуют три разных углеводорода. Это изомерия углеродного скелета. Рис. 2.

Рис. 2 Примеры веществ – структурных изомеров
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения.


Рис. 3. Структурная изомерия положения
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4

Рис. 4. Положение атомов хлора вокруг одинарной связи
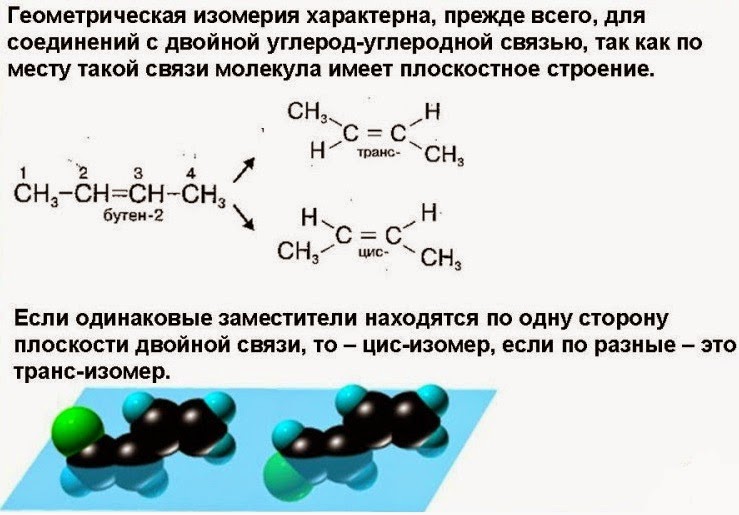
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах – по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.



Рис. 5. Цис- и транс- изомеры
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру – тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия. Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью – от греческого сhier – «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
|
|
|
Рис. 6. Примеры оптических изомеров
Оптическая изомерия называется также энантиомерией (от греческого enantios – «противоположный» и meros – «часть»), а оптические изомеры – энантиомерами. Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d-, или (+)-изомер, – вправо, l-, или (–)-изомер, – влево. Смесь равных количеств энантиомеров, называемая рацематом, оптически недеятельна и обозначается символом d,l- или (±).
ИСТОЧНИКИ
источник видео - http://www.youtube.com/watch?v=mGS8BUEvkpY
http://www.youtube.com/watch?t=7&v=XIikCzDD1YE
http://interneturok.ru/ru/school/chemistry/10-klass - конспект
источник презентации - http://ppt4web.ru/khimija/tipy-izomerii.html
http://www.youtube.com/watch?t=2&v=ii30Pctj6Xs
http://www.youtube.com/watch?t=1&v=v1voBxeVmao
http://www.youtube.com/watch?t=2&v=a55MfdjCa5Q
http://www.youtube.com/watch?t=1&v=FtMA1IJtXCE
источник презентации - http://mirhimii.ru/10class/174-izomeriya.html