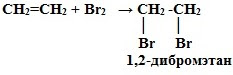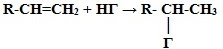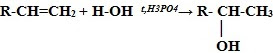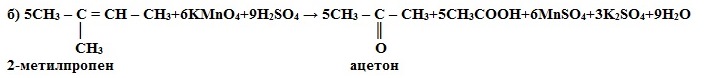10 класс. Химия. Алкены. Химические свойства
10 класс. Химия. Алкены. Химические свойства
Комментарии преподавателя
Характеристика двойной связи в алкенах


Рис. 1. Строение этилена
Электроны π-связи более доступны для внешних воздействий, эта связь менее прочна, чем σ-связь. Следовательно, π-связь более реакционноспособна, и химические свойства алкенов во многом должны быть связаны с разрывом именно этой связи. Рис. 1. Самая характерная реакция алкенов – реакция электрофильного присоединения по двойной связи. Для взаимодействия алкенов со многими веществами не нужно ни нагревания, ни освещения.
Реакция протекает при нагревании, повышенном давлении и в присутствии катализаторов Ni, Pt или Pd. Эта реакция не является электрофильным присоединением.

Электрофильное присоединение (АЕ)
Электрофильные реакции – реакции, начинающиеся с атаки электрофила на кратную связь.
Электрофил – положительно заряженная частица, которая притягивается к электронной плотности и тем самым инициирует реакцию.
Реакция алкена с хлороводородом начинается с того, что полярная молекула галогеноводорода притягивается положительно заряженной частью, т.е. атомом Н, к двойной связи (p-комплекс):

Затем атом водорода образует s-связь с одним из атомов углерода за счет двух электронов двойной связи. Другой атом углерода при этом приобретает положительный заряд. Получается положительно заряженная частица – карбкатион (s-комплекс):
 Сl-
Сl-
Рядом с карбкатионом остается хлорид-анион, который быстро образует связь с положительно заряженным атомом углерода:

Сравним два катиона, которые могут образоваться при присоединении иона Н+ к двойной связи:

В катионе I положительно заряженный атом углерода с двух сторон окружен CH3-группами. Притягивая их электронную плотность, он частично компенсирует свой заряд. У катиона II рядом только одна такая группа. Поэтому катион I более устойчив, чем катион II, и реакция будет протекать через его образование.

Правило Марковникова:Атом водорода присоединяется к тому атому углерода двойной связи, у которого больше атомов водорода.
Далее хлорид-анион быстро образует связь с положительно заряженным атомом углерода:


Примеры реакций электрофильного присоединения
1. Галогенирование.
Непредельные соединения быстро обесцвечивают раствор брома в воде – бромную воду. Это – качественная реакция на кратные связи.

2. Гидрогалогенирование.

3. Присоединение серной кислоты.
Серная кислота обязательно должна быть концентрированной.

4. Гидратация.
Реакция алкена с разбавленным раствором серной кислоты приводит к образованию спирта. Кислота в этой реакции является катализатором присоединения воды к алкену.

****************************************************
|
Химические свойства алкенов Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения. Реакции присоединения 1. Гидрирование (гидрогенизация – взаимодействие с водородом): CnH2n + H2 t, Ni → CnH2n+2 2. Галогенирование (взаимодействие с галогенами): CnH2n + Г2 → СnH2nГ2 Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается. 3. Гидрогалогенирование* (взаимодействие с галогенводородами): 4. Гидратация* (присоединение молекул воды): CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт) * Присоединение галогенводородов и воды к несимметричным алкенам происходит поправилу Марковникова В.В. Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи. Исключения!!! 1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность: F3C ← CH=CH2 + H-Br → F3C - CH2 - CH2(Br) 1,1,1- трифтор-3-бромпропан 2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси (R-O-O-R ): СH3-CH=CH2 + H-Br Н2О2 → H3C - CH2 - CH2(Br) 5. Реакции полимеризации: nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n мономер - этилен полимер – полиэтилен Реакции окисления 1. Горение: CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя ярко светящее) Частичное окисление этилена 2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается. Влияние среды на характер продуктов реакций окисления 1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2): а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH + 8MnSO4 +4K2SO4 + 12H2O в) CH3 – CH2 – CH = CH2 + 2KMnO4 + 3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O 2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше) ИСТОЧНИКИ |
источник видео - http://www.youtube.com/watch?t=5&v=7NcVWKV5Aqk
http://www.youtube.com/watch?v=x6WSEKw8I-I
http://www.youtube.com/watch?t=2&v=mpfb-8WrCQE
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia/urok-no13-fiziceskie-i-himiceskie-svojstva-alkenov - конспект
источник презентации - http://ppt4web.ru/khimija/khimicheskie-svojjstva-alkenov-poluchenie.html
http://interneturok.ru/ru/school/chemistry/10-klass - конспект